钠离子内流是细胞生命活动中关键的生理过程,是产生膜内外电位的基础,其主要通过钠离子通道或转运体来实现。一旦钠离子内流受阻,细胞内外电生理信号调节受到影响,就会引起多种钠离子通道病,如家族性高热惊厥、高钾性周期性麻痹、III型长QT综合征等。因而,解决钠离子内流阻滞问题不仅可以调控细胞动作电位,而且有望治疗钠离子通道病。目前,科研工作者们在揭示天然钠离子通道的精细结构和离子选择性机制方面面临着很大的困难,在体内直接应用天然钠离子通道来治疗钠离子传导阻滞疾病更是难以实现。化学科研人员通过创制结构简单、性能优异的人造通道将为弥补天然钠离子通道突变导致的功能缺陷提供独特的化学途径,然而钠离子选择性跨膜的化学研究面临着极大的挑战,成为当前科学界亟待解决的难题。

图1. (a)水合钠离子晶体结构以及模拟五水合配位结构的分子设计;(b)五种纳米孔的分子结构;(c)含纳米孔的螺旋分子以通道或离子载体方式传输钠离子示意图。
吉林大学董泽元教授课题组以钠离子的五水合晶体结构为模型,利用喹啉-噁二唑结构序列精确复制其空间配位位点,设计合成了一系列螺旋折叠纳米孔(图1)。通过模拟钠离子五水合结构,这些设计的纳米孔展现出优异的钠离子选择性跨膜传输功能,其中M1和M3的离子选择性达到了天然钠通道的水平。研究也发现,通过细微改变纳米孔结构能够实现通道与离子载体之间的转运模式的变换,有助于理解钠离子选择性传输背后的分子机制。
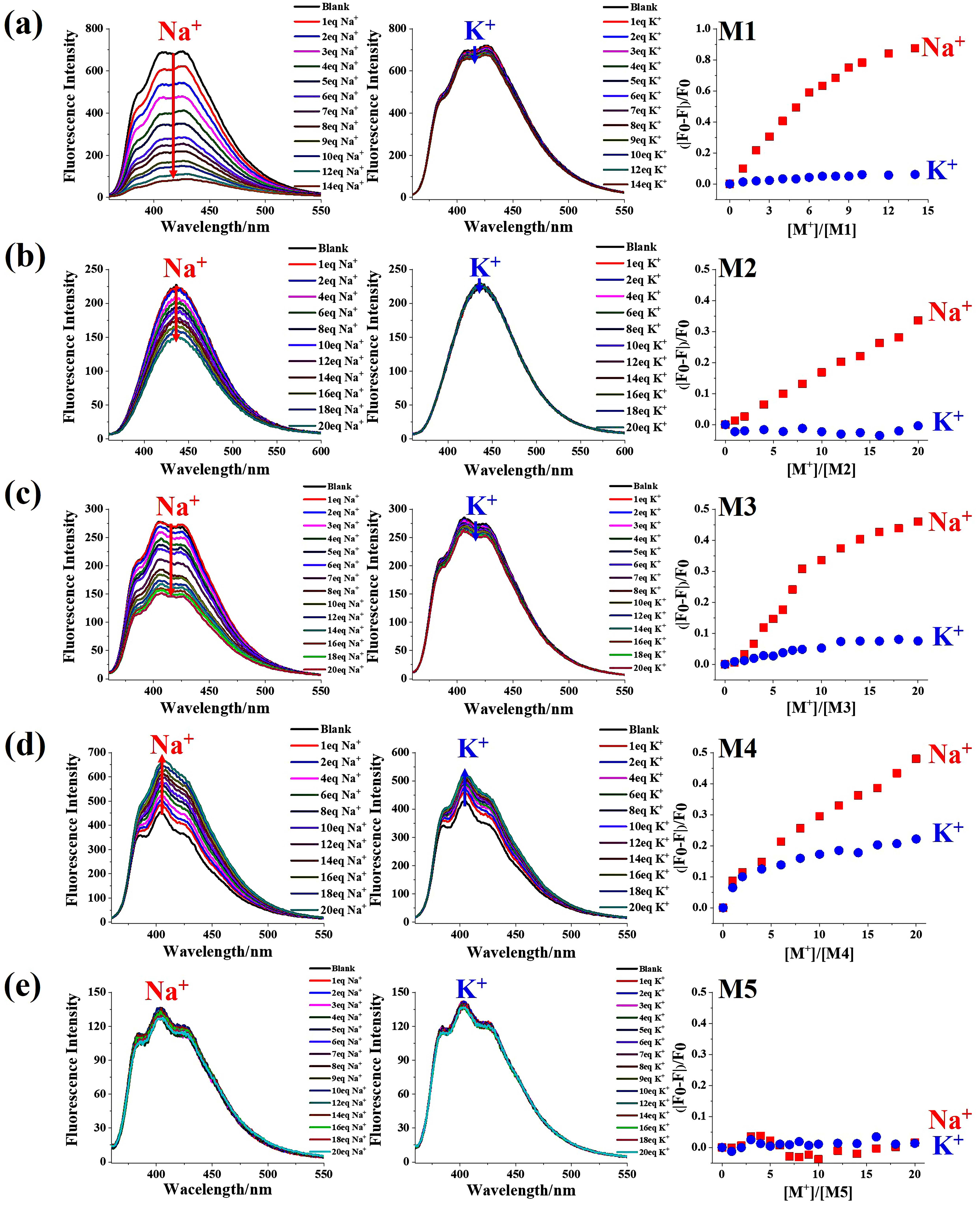
图2.不同纳米孔结构M1-M5对钠离子和钾离子的荧光滴定谱图。
为了验证纳米孔的离子选择性,作者分别通过荧光滴定与核磁滴定实验测试了M1-M5对Na+和K+的离子识别能力。荧光滴定实验(图2)证实M1-M3与钠离子形成1:1的复合物,其2.1Å的孔径与钠离子(2.04Å)匹配,而几乎不结合尺寸稍大的钾离子(2.76Å)。有趣的是,将纳米孔结构中一个结合位点的位置稍加变动,分子M4对钠离子和钾离子均表现出明显的结合能力,导致其钠/钾离子选择性降低;当纳米孔结构中缺失一个结合位点后,分子M5对钠离子和钾离子的结合能力都几乎消失。这些结果表明纳米孔结构中离子结合位点的数量和位置对离子识别能力及其离子选择性起到关键的作用。
作者利用体外磷脂囊泡实验研究了M1-M5对Na+和K+的跨膜传输能力。实验发现,除了M5之外,M1-M4都表现出优异的钠离子选择性传输性质,其钠/钾离子选择性比值(PNa/K)分别为20.4、5.6、13.4和1.9,且对二价金属离子如Ca2+、Mg2+没有明显的传输活性。值得关注的是,M1和M3的PNa/K值达到了天然钠离子通道的水平(PNa/K值范围在12到50之间)。此外,基于温敏脂质体(相变温度41℃)的离子传输测试可以证实M1-M3的钠离子转运机制。当温度高于41℃时,M1-M3都表现出显著的钠离子传输活性;当温度低于41℃时,仅M3对钠离子保持较高的传输活性,而M1和M2对钠离子的传输能力消失。这表明M3以通道模式传输钠离子,而M1和M2以离子载体模式传输钠离子。平面脂质膜片钳(BLM)实验观察到典型的通道电流信号,证实了M3以通道模式传输钠离子(图3)。通过不对称BLM实验发现M3的逆转电势为65.9 mV,计算得出其PNa/K为13.0 ± 1.5(图3),清晰地证明M3是高选择性的钠离子通道。此外,钠离子载体M1在离子选择性方面远优于商用Na+载体ETH2120,因而M1可以作为一种实用性Na+跨膜载体。
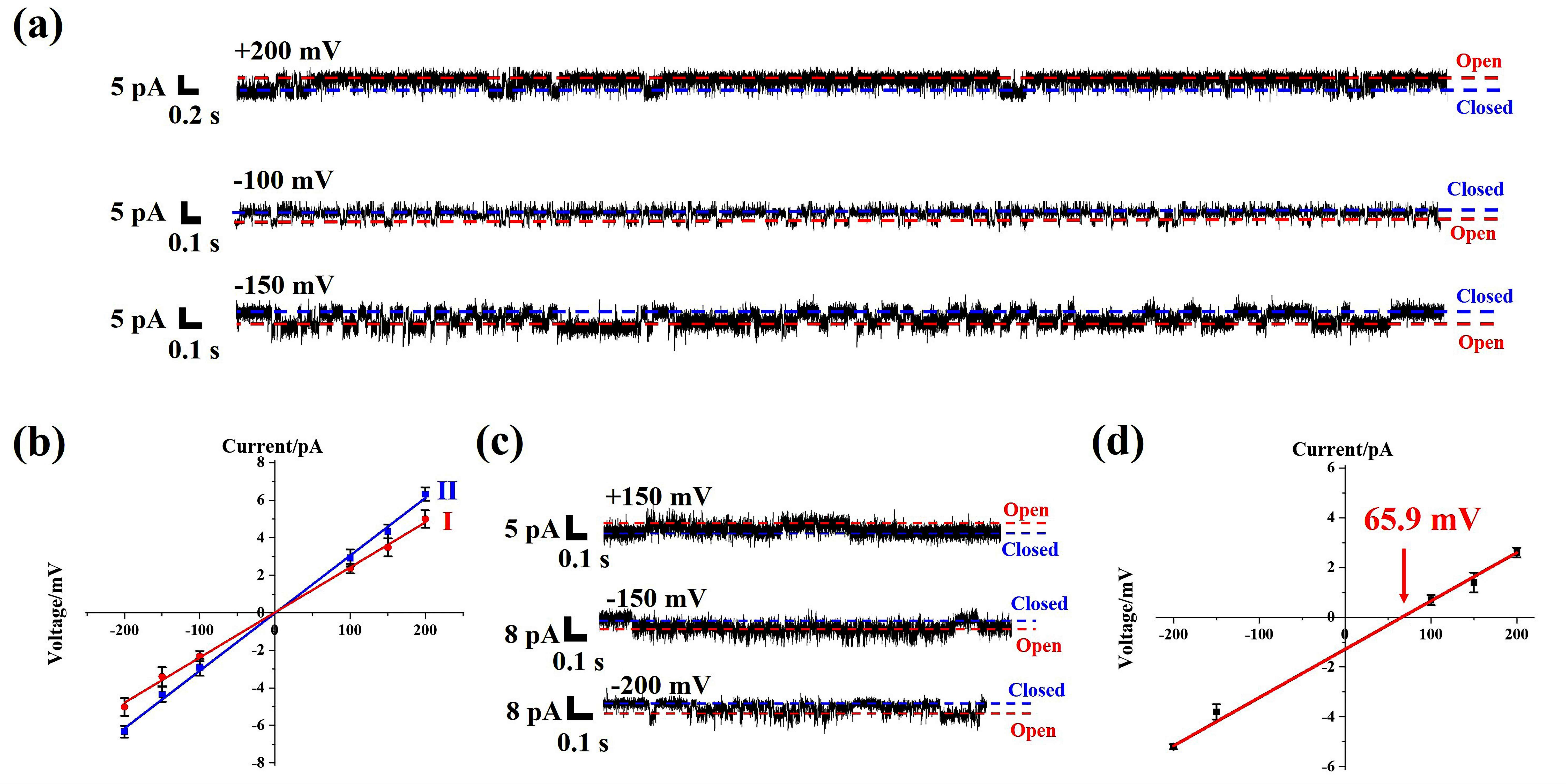
图3.仿生钠离子通道M3的BLM测试分析图。
总之,作者利用分子螺旋折叠方式精确模拟钠离子的五水合配位结构,设计合成了一系列基于喹啉-噁二唑序列的螺旋折叠纳米孔,实现了高选择性的钠离子跨膜传输,其离子选择性达到天然体系的水平。同时,研究表明纳米孔结构中离子结合位点的数量和位置对离子识别能力及其离子选择性起到关键的作用。这项研究不仅可以从分子水平理解钠离子选择性的作用机制,而且有望建立通过操控钠离子来调控细胞功能的新技术,发展治疗钠离子传导阻滞疾病的新策略。
相关的研究成果近期发表在JACS杂志上,文章第一作者为吉林大学张磊博士,通讯作者为吉林大学董泽元教授。
文章详情:Lei Zhang, Jun Tian, Ze Lin, and Zeyuan Dong*.Efficient Sodium Transmembrane Permeation through Helically Folded Nanopores with Natural Channel-Like Ion Selectivity,J. Am. Chem. Soc. 2024,DOI: 10.1021/jacs.3c14736.
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.3c14736